近红外荧光共聚焦显微成像系统
在生物医学、材料科学、光电子器件及生物医药工程等科学研究领域,目标样品(如活体小动物深层组织、NIR-II 量子点 / 钙钛矿微纳结构、生物靶向荧光探针标记的细胞)常呈现动态演化、多结构层级且受环境敏感的复杂特征,其核心性能(如组织成像深度、材料发光均匀性、探针靶向效率)与空间分布、时间动态及光 - 物质相互作用紧密绑定。传统单一成像技术仅能从单维度获取信息,难以突破 “浅层成像局限” 与 “高背景干扰” 的双重瓶颈,无法全面解析 NIR-II 波段有的深层、高分辨成像需求。而近红外二区荧光共聚焦显微成像系统通过整合 NIR-II 波段优势、共聚焦空间分辨能力与原位动态监测功能,实现了对样品从亚微米微观结构到数毫米深层组织的全方成像解析,已成为突破 NIR-II 相关复杂体系研究瓶颈的核心技术。
任何非 NIR-II 波段的成像技术或非共聚焦模式,都存在深层成像能力与空间分辨率的固有局限,仅能反映样品的部分属性,无法完整捕捉 NIR-II 领域的核心研究需求。例如,可见光共聚焦成像虽具备亚微米空间分辨率,却因生物组织对可见光的强散射与吸收,穿透深度仅数百微米,难以覆盖小鼠脑部、肝脏等深层组织;NIR-I 荧光成像(700-900 nm)虽穿透深度略有提升,但仍受限于组织泛频吸收,背景噪声显著,无法清晰区分肿瘤边界与正常组织;普通宽场 NIR-II 成像虽能利用 “生物光学窗口”(1000-1700 nm)实现数毫米穿透,却缺乏共聚焦的空间层析能力,无法定位深层组织中的亚微米结构(如毛细血管分支);瞬态荧光成像虽能捕捉发光动力学,却无法关联 NIR-II 波段有的深层空间分布 —— 这就需要借助近红外二区荧光共聚焦显微成像系统,通过 “NIR-II 波段低散射 + 共聚焦高分辨” 的协同优势,填补深层、高分辨成像的关键空白,Z大化与其他技术的互补性。(参考文献:Schmidt et al., Nat Rev Methods Primers 4, 23 (2024).)
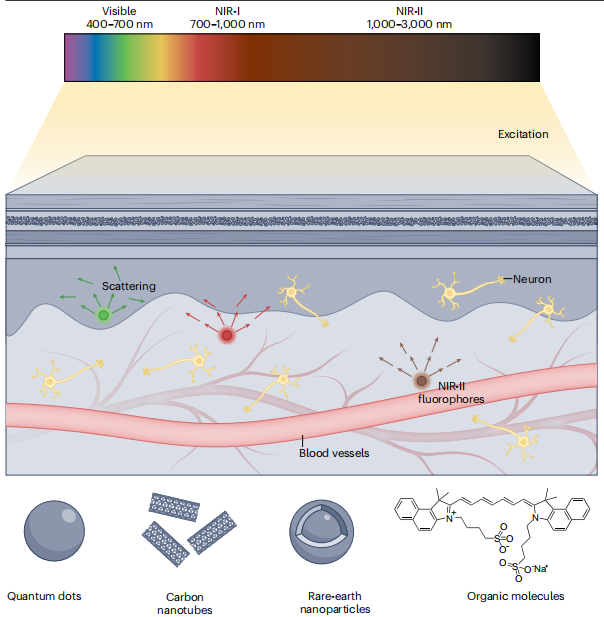
图1. 近红外二区荧光成像
在光学信息探测领域,近红外二区荧光共聚焦显微成像系统常集成原位环境调控(温度、湿度、气体氛围,适配活体生物样品)与多模态数据关联(同步采集荧光强度、空间层析图像、时间分辨发光信号)功能,通过高数值孔径 NIR-II 专用物镜聚焦激发光、针孔过滤背景杂光,确保在统一空间 - 深度坐标系下同步获取样品的三维荧光分布与动态演化数据,有效规避了传统分步检测中 “样品位移导致的结构错位”“环境变化引发的荧光淬灭” 等问题。由于生物组织对 NIR-II 光的散射与吸收仅为可见光的 1/10-1/5,且该系统具备低光毒性(减少组织光损伤),可实时解析 “光 - NIR-II 探针 - 生物组织” 的跨维度相互作用机制 —— 例如,在活体小鼠脑部成像中,能清晰呈现数毫米深度下的毛细血管管径、血流速度分布;在 NIR-II 量子点微纳结构表征中,可定位亚微米级区域的发光缺陷。这种原位融合策略不仅为 NIR-II 微纳材料的界面发光机制、生物组织的生理功能(如肿瘤血管新生)等微观机理研究提供了直接证据,还通过 “动态监测 + 深层层析” 技术的结合,为揭示复杂体系(如肿瘤微环境与探针相互作用)的跨尺度作用规律奠定了核心方法学基础。
近红外二区荧光共聚焦显微成像系统的核心价值,不仅在于 “NIR-II 波段优势 + 共聚焦分辨能力” 的协同应用,更在于其产生的 “空间 - 深度 - 时间” 多维度成像数据的深度耦合与智能解析。这种融合突破了传统成像技术 “浅层局限”“分辨率 - 穿透深度权衡” 的 “数据孤岛” 问题,通过建立 “样品空间分布 - 深层组织响应 - 时间动态演化” 的跨尺度关联模型,实现了对复杂体系的全息化认知 —— 例如,在肿瘤诊断中,可同时获取肿瘤边界的空间位置、深层血管的供血状态及探针的靶向结合效率;在 NIR-II 材料表征中,能关联微区发光强度与晶体结构的均匀性。尤其在当前人工智能与深度学习快速发展的背景下,该系统产生的大通量成像数据(如活体组织三维荧光图谱、材料微区发光动态曲线)与深度学习算法结合,可实现肿瘤区域自动识别、血流动力学参数定量分析、NIR-II 材料缺陷智能定位,必将突破现有 “经验驱动” 的成像与表征范式,迈入以数据驱动的 NIR-II 科学研究新阶段。
应用案例:
1. 时间-空间-能量多维度解析生物组织深层动态与分子机制
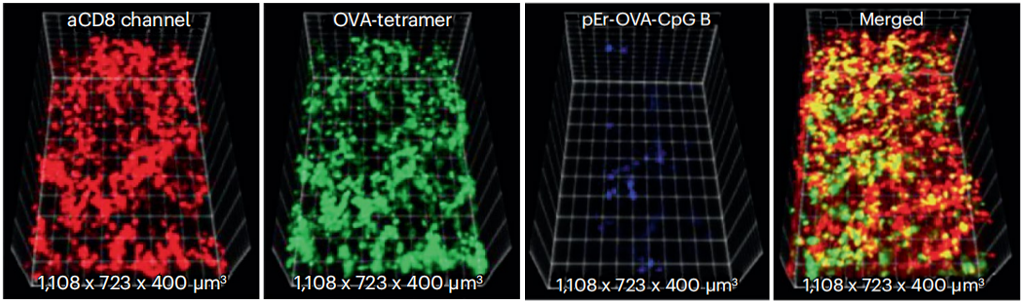
图2. 肿瘤中CD8+ T细胞(红色)、卵白蛋白抗原特异性T细胞(绿色)和pernp - ovacase -B胞嘧啶-磷酸-鸟嘌呤(CpG B)纳米疫苗(蓝色)的三维(3D)重建NIR-II图像[1]
更进一步,若在时间分辨与空间成像的基础上引入能量轴(E,即探针发射波长),则可以在由时间延迟(t)、空间位置(r)与光子能量(E)组成的三维空间(t-r-E 相空间)中绘制探针信号的发射分布图,即 I (t,r,E) 图谱。这类图谱允许研究人员同时追踪探针的时间演化规律(如血流前沿移动、淋巴转运时效)、空间分布特征(如肿瘤靶向聚集区域、深层血管分支)与能量适配特性(如发射波长与 NIR-II 亚区的匹配度),揭示不同探针 - 生物相互作用状态下信号发射的选择性起源。例如,在活体生物组织成像中,不同时间、空间与能量下的 NIR-II 探针信号呈现显著差异:FDA 批准的 ICG 凭借尾发射延伸至 NIR-IIa 区(1300-1400 nm),在人类肝肿瘤手术中可实时定位亚毫米级转移灶(空间分辨率~2 μm),时间维度上能追踪术后 24 小时内探针的肝肾清除动态;NaYbF₄:Er 稀土纳米颗粒(RENPs)发射 1550 nm NIR-IIb 波段信号,穿透小鼠完整颅骨后仍保持 SNR>10,空间上清晰区分脑部动脉(红色)与静脉(蓝色)分支,能量上匹配组织散射最小化窗口,时间上通过 > 20 帧 / 秒的动态成像捕捉心脏周期引发的血流波动;CH-4T@蛋白复合物发射 1000 nm NIR-II 信号,在淋巴成像中可与血管探针(DCNPs,1060 nm)形成双色成像,空间上精准区分腹股沟淋巴结与周围血管网络,时间上追踪探针从皮内注射到淋巴结的转运过程(~30 分钟达峰);NIR-II 荧光成像可用于判定 RENPs 为 “深层脑组织成像优先探针”(适配 NIR-IIb 低散射窗口),ICG 为 “临床转化优先探针”(FDA 批准属性),同时识别组织自体荧光随波长增加的衰减规律(>1300 nm 可忽略)引发的 SNR 提升效应。
2. 量子点探针的制备与 NIR-II 深层生物成像应用
近红外二区(NIR-II,1000-1700 nm)荧光成像凭借低组织散射、低自体荧光的独特优势,在深层组织高分辨率成像领域展现出巨大潜力,成为生物医学成像的重要研究方向。然而,现有 NIR-II 荧光团(如有机染料、碳纳米管、稀土纳米晶)普遍存在量子产率低、化学稳定性差或生物相容性不足的问题;虽 PbS 量子点(QDs)具有高量子产率(可达 60%),但其重金属(Pb²⁺)泄漏毒性、S²⁻易氧化导致的光学稳定性缺陷,严重限制了其在活体成像中的应用。近年来,PbS@CdS 核壳结构 QDs 通过 CdS 壳层初步改善了 Pb²⁺泄漏问题,而 SiO₂与 FDA 批准的两亲性聚合物 Pluronic F-127 的双层包覆策略,可进一步协同提升材料的化学稳定性与生物相容性 ——SiO₂层提供物理隔绝以抑制氧化和离子泄漏,F-127 层赋予水溶性与抗生物吸附能力,通过构建 PbS@CdS@SiO₂@F-127 纳米颗粒(NPs),有望突破 NIR-II 荧光探针 “高亮度 - 高稳定 - 低毒性” 难以兼顾的瓶颈,为脑血管、胃肠道等深层组织成像提供新方案。
在该研究中,采用反相微乳液法、表面嫁接改性及超声分散工艺制备目标量子点,并结合透射电子显微镜(TEM)、动态光散射(DLS)、稳态 / 瞬态荧光光谱、原子吸收光谱(AAS)及 InGaAs 相机成像系统,系统揭示了 PbS@CdS@SiO₂@F-127 NPs 的本征光学特性、化学稳定性及生物成像性能,发现其具有高量子产率(~5.79%,远超多数现有 NIR-II 荧光团)、宽 pH 范围化学稳定性(pH 1-13 内 24 h 荧光变化 <30%)、低体内外毒性(UMUC3 细胞 10 μg/mL 浓度下存活率> 90%),以及超快体内清除(胃肠道灌胃后 4.5 h 随粪便排出)等优势;这些性能提升归因于 SiO₂-F-127 双层结构的协同作用 ——SiO₂壳层物理隔绝氧气与水以抑制 QDs 氧化,F-127 的 PEG 链段降低蛋白吸附并提升水溶性,而两者形成的致密包覆层有效阻断 Pb²⁺/Cd²⁺泄漏,同时 n 型 QDs 与包覆层间的界面相互作用优化了荧光发射特性。(参考文献:Zebibula et al., Adv. Funct. Mater., 32: 2200386 (2022))

图3. 同一小鼠脑血管在不同深度拍摄的 NIR-II 荧光图像
实验结果有效确认了单层 CdS 壳层对 PbS 核的保护作用(降低 Pb²⁺泄漏率)和 SiO₂-F-127 双层包覆对化学稳定性的提升效果,凸显了 PbS@CdS@SiO₂@F-127 NPs NIR-II 成像性能:其发射峰位于 1155 nm(适配 NIR-IIa 低散射窗口),在小鼠脑血管成像中实现 950 μm 深度的血管网络清晰可视化,3D 重建图像可分辨软脑膜毛细血管;在胃肠道成像中,以 80 μg/kg 的低剂量灌胃,即可实现 3-5 mm 深度的消化器官动态追踪(10 min 显胃轮廓、4.5 h 达大肠并随粪便排出),7 d 后体内无残留。同时,这些结果也直接指导了探针的实验参数选择:激发波长确定为 785 nm(匹配 PbS@CdS QDs 的高激发效率),成像检测窗口锁定 1100-1700 nm(滤除激发光杂散光);其中,不同 pH 条件下的荧光强度变化图谱为双层包覆的化学稳定性提供了直接光学证据,而活体成像中的荧光信号动态演化(如脑血管血流波动、胃肠道探针迁移轨迹),则进一步验证了该量子点在深层组织动态监测中的可靠性。
3. 生物相容水溶性短波红外(SWIR)发射花菁类荧光探针的合成与活体乳腺癌多维度分子成像应用
短波红外(SWIR,900-1400 nm)成像凭借低组织散射、低自体荧光的独特优势,在深层组织生物分子可视化领域展现出巨大应用潜力,尤其为乳腺癌等实体瘤的精准成像提供了新方向。然而,当前临床及科研中可用的 SWIR 荧光探针存在显著局限:经 FDA 批准的近红外(NIR)探针吲哚菁绿(ICG),虽可延伸至 SWIR 波段发射,但激发波长限于 800 nm 以下,仅支持单色成像,无法满足多靶点同步监测需求;其他 SWIR 荧光团(如碳纳米管、量子点)则面临生物相容性差、水溶性不足或合成复杂的问题。近年来,基于 ICG 的 π- 共轭扩展花菁类染料因结构可调性强、生物安全性高备受关注,其中 ICG-C9 与 ICG-C11 通过增加多甲川链双键数量(分别比 ICG 多 1 个、2 个双键),实现发射波长红移至 SWIR 核心波段,且依托 ICG 母核的生物相容性基础,可通过表面修饰实现水溶性优化。通过构建 ICG/ICG-C9/ICG-C11 基探针与抗体、凋亡标志物或抗癌药物的偶联物,能够协同 SWIR 成像优势与靶向识别能力,实现乳腺癌表面受体、肿瘤血管及凋亡过程的多维度解析,为 SWIR 分子成像的临床转化提供新思路。(参考文献:Mahadeva et al., ACS Appl. Mater. Interfaces.,16, 17253−17266(2024).)
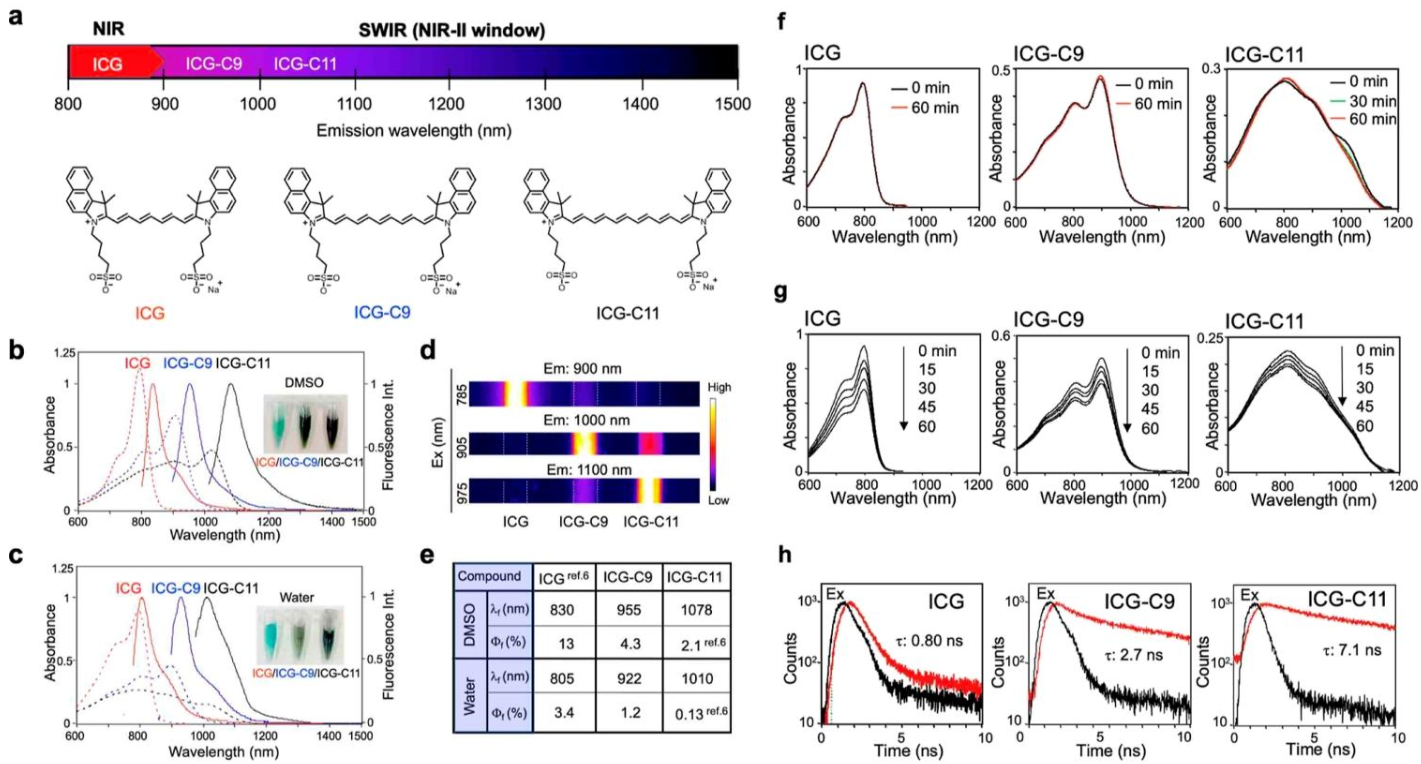
图4. 吲哚菁绿(ICG)、ICG-C9 与 ICG-C11 的光学特性综合表征包含吸收光谱、荧光光谱、荧光发射峰值与量子产率和荧光发射寿命
在该研究中,采用有机合成、稳态 / 瞬态光谱表征及活体成像技术,系统揭示了 ICG-C9/ICG-C11 探针的本征光学特性与生物成像性能,发现其具有精准 SWIR 波段发射(水相 1% BSA 中,ICG-C9 发射 922 nm、ICG-C11 发射 1010 nm)、优异生物相容性(HeLa 细胞 10 μM 浓度下存活率 > 90%,体内 4 周肝肾功能指标正常)及稳定成像能力(1% BSA 中激光照射 60 min 光漂白率 < 30%),这些性能提升归因于 π- 共轭扩展带来的波长红移效应、BSA 与探针的复合作用增强稳定性,以及花菁母核继承的 ICG 生物安全性。
实验结果有效确认了 ICG-C9/ICG-C11 的 π- 共轭扩展结构与 SWIR 发射特性的关联(每增加 1 个双键,发射波长红移~100 nm),以及 NHS 酯、马来酰亚胺、炔烃三类标记试剂与抗体(Herceptin、Erbitux)、annexin V、抗癌药物 Kadcyla 的高效偶联能力,凸显了该类探针多色 SWIR 成像适应性 —— 通过 785 nm(ICG)、905 nm(ICG-C9)、975 nm(ICG-C11)差异化激发与对应波段滤光片(900±25 nm、1000±25 nm、1100±25 nm),可实现乳腺癌 HER2/EGFR 受体与肿瘤血管的三色同步成像;同时,该结果也直接指导了凋亡成像的探针组合选择(ICG-Kadcyla 与 ICG-C9/IC11-annexin V)及长期监测的波长参数(ICG-C9-Kadcyla 采用 905 nm 激发、>1000 nm 探测)。其中,稳态吸收 / 荧光光谱证实了探针 - 生物分子偶联后的光学特性保留,瞬态荧光 decay 曲线(ICG-C9 寿命 2.7 ns、ICG-C11 寿命 7.1 ns)为 SWIR 信号的时间分辨识别提供了必要光学证据,而活体成像的信号分布则验证了探针的靶向性。